摘要:密歇根大学一个研究小组正在开发一种新的抗癌药物,这种药物通过肠道的淋巴系统而不是血管吸收,有可能战胜导致耐药性的分子信号通路,同时提高抗癌能力和减少副作用。很值得留意。
密歇根大学(University of Michigan)的一个研究小组正在开发一种新的抗癌药物,这种药物通过肠道的淋巴系统而不是血管吸收,有可能战胜导致耐药性的分子信号通路,同时提高抗癌能力和减少副作用。今天发表在《Nature Communications》的一项研究报告了一种新型激酶抑制剂,它能显著降低骨髓纤维化(急性白血病的前兆)小鼠的疾病,延长生存期。
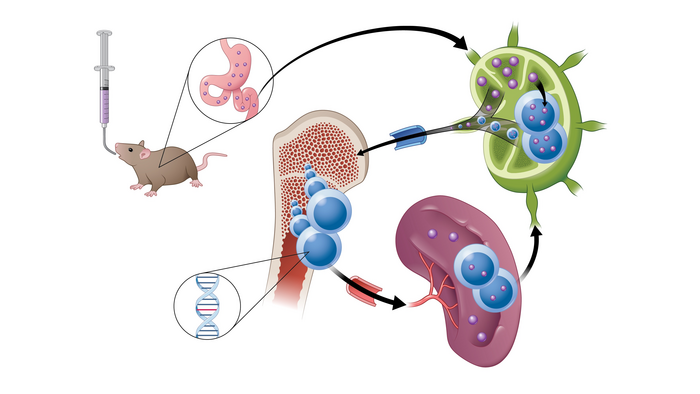
图:展示这种新型药物如何通过淋巴系统被吸收的模型
来源:DANIELLE DOBBS/MICHIGAN MEDICINE/密歇根医学院
“癌症的联合疗法经常受到剂量限值毒性的困扰。尽管预计通过胃肠道淋巴系统吸收和转运的药物吸收途径能有助于避免肝脏首关代谢、改善药物暴露、减少剂量限值毒性、维持药物水平、提高全身生物利用度,但一直以来很少有这方面的探索。(首关代谢指药物从消化道吸收,随血流进入肝脏再到达血循环的过程中,因在肝脏等部位受酶的作用而被代谢分解,丧失部分药效(效价),使进入体循环的有效药量减少的效应。这种效应明显降低了药物的口服生物利用度。)部分原因可能是对淋巴吸收而非门静脉吸收的小分子所需的化学和药代动力学特性的理解有限。先前证明可实现淋巴吸收的小分子包括维生素 D3 和 E 、合成大麻素等。
利用合成药物化学和计算对接研究,密歇根大学的研究人员报告了一种针对 PI3K 和 MAPK 信号通路的强选择性、口服生物可利用的单分子多功能激酶抑制剂 (LP-182) 的开发。LP-182 独特的理化性质使之在口服后可实现淋巴吸收——通过在肠系膜淋巴系统中的隔离可使得全身血液循环中药物和活性代谢物水平增加,提高了整体生物利用度并减少了可观察到的毒性。
磷酸肌醇3激酶(PI3K)和丝裂原活化蛋白激酶(MAPK)这两种分子信号通路驱动多种癌症,是实体恶性肿瘤中改变较多的致癌信号通路之一,由于靶点抑制不足、代偿性信号激活和下游靶点趋同,使用单通路抑制剂的临床效率一直很差。即使一种药物阻断了一个通路,另一个通路也可以提供一个逃逸生存通路来补偿和继续生长。
LP-182 在体外和体内均实现了对 PI3K 和 MAPK 信号通路的选择性有效抑制。口服给药导致血浆半衰期延长,这归因于LP-182首先被肠道淋巴系统中活性脂蛋白转运途径吸收。淋巴系统作为一个储存库,将药物从身体的其他部分隔离出来,并随着时间的推移逐渐将药物释放到全身循环中,以保持药物浓度在好的治疗水平。
骨髓纤维化(MF)是一种明显累及继发性淋巴器官(如脾脏)的血液肿瘤。骨髓纤维化主要源于造血干细胞和祖细胞(HSPCs)的突变激活了JAK2激酶。在骨髓纤维化中,骨髓中会形成过多的疤痕组织,破坏正常的血细胞生成。过度活跃的分子信号传导导致恶性干细胞增殖、广泛纤维化、脾脏肿大和进行性骨髓衰竭。标准治疗JAK2抑制剂(Ruxolitinib, Fedratinib)的耐药性已被证明是代偿性PI3K和MAPK生存信号同时激活的结果。
在骨髓增生性白血病癌基因(MPLW515L)小鼠骨髓纤维化(MF)模型的临床前研究表明,LP-182可改善脾肿大和纤维化疾病表型、延长总生存期。MPLW515L小鼠模型口服LP-182还可导致骨髓和分离脾细胞中血液细胞数量的恢复,以及下游蛋白激酶B (PKB/AKT)和细胞外信号调节蛋白激酶1/2 (ERK1/2)信号活性的减弱。

多功能激酶抑制剂LP-182表现出的选择性和特异性
癌症治疗通常涉及针对不同癌细胞弱点的综合治疗。密歇根大学医学院放射学研究教授、第一作者Brian D. Ross博士说,由于这些药物在体内循环、被人体吸收和移除的速度不同,在限制药物毒性和副作用的同时维持每种药物在有效的必要浓度下的正确治疗平衡可能是一项挑战。
“在治疗窗口内,我们能够保持对这两种不同但能相互补偿的信号通路的靶向抑制,”Ross说,“这证明了将抗癌药物直接输送到淋巴系统的可行性,这为改善癌症治疗结果和减少药物本身的副作用打开了巨大的新机会。”
骨髓纤维化通过淋巴组织传播,这也是癌症转移的常见途径,因此Ross和他的团队的发现可能为防止癌症扩散提供新的策略。此外,Ross说,因为肠道的淋巴系统容纳了超过一半的身体免疫细胞,这项研究的结果可以为治疗自身免疫性疾病和其他疾病提供方法。
Ross和他的同事将继续扩大LP-182的临床前研究,目标是在人类骨髓纤维化患者中开展一期临床试验。他们还在开发更多的淋巴靶向激酶抑制剂,用于治疗实体肿瘤,包括乳腺癌、脑癌、胃肠道和胰腺癌,以及狼疮和多发性硬化症等自身免疫性疾病。
该研究的亮点在于证明了制备经由淋巴吸收多靶点激酶抑制剂的合成方案,以及对淋巴吸收中心的物理化学特征的表征,为推进经由淋巴吸收的小分子疗法在人类疾病治疗中的应用提供了一条途径。
参考资料:
[1]Brian D. Ross, Youngsoon Jang, Amanda Welton, Christopher A. Bonham, Dilrukshika S. W. Palagama, Kevin Heist, Jagadish Boppisetti, Kasun P. Imaduwage, Tanner Robison, Leah R. King, Edward Z. Zhang, Cyrus Amirfazli, Kathryn E. Luker, Winston Y. Lee, Gary D. Luker, Thomas L. Chenevert & Marcian E. Van Dort, A lymphatic-absorbed multi-targeted kinase inhibitor for myelofibrosis therapy, Nature Communications volume 13, Article number: 4730 (2022)
摘要:密歇根大学一个研究小组正在开发一种新的抗癌药物,这种药物通过肠道的淋巴系统而不是血管吸收,有可能战胜导致耐药性的分子信号通路,同时提高抗癌能力和减少副作用。很值得留意。
密歇根大学(University of Michigan)的一个研究小组正在开发一种新的抗癌药物,这种药物通过肠道的淋巴系统而不是血管吸收,有可能战胜导致耐药性的分子信号通路,同时提高抗癌能力和减少副作用。今天发表在《Nature Communications》的一项研究报告了一种新型激酶抑制剂,它能显著降低骨髓纤维化(急性白血病的前兆)小鼠的疾病,延长生存期。

图:展示这种新型药物如何通过淋巴系统被吸收的模型
来源:DANIELLE DOBBS/MICHIGAN MEDICINE/密歇根医学院
“癌症的联合疗法经常受到剂量限值毒性的困扰。尽管预计通过胃肠道淋巴系统吸收和转运的药物吸收途径能有助于避免肝脏首关代谢、改善药物暴露、减少剂量限值毒性、维持药物水平、提高全身生物利用度,但一直以来很少有这方面的探索。(首关代谢指药物从消化道吸收,随血流进入肝脏再到达血循环的过程中,因在肝脏等部位受酶的作用而被代谢分解,丧失部分药效(效价),使进入体循环的有效药量减少的效应。这种效应明显降低了药物的口服生物利用度。)部分原因可能是对淋巴吸收而非门静脉吸收的小分子所需的化学和药代动力学特性的理解有限。先前证明可实现淋巴吸收的小分子包括维生素 D3 和 E 、合成大麻素等。
利用合成药物化学和计算对接研究,密歇根大学的研究人员报告了一种针对 PI3K 和 MAPK 信号通路的强选择性、口服生物可利用的单分子多功能激酶抑制剂 (LP-182) 的开发。LP-182 独特的理化性质使之在口服后可实现淋巴吸收——通过在肠系膜淋巴系统中的隔离可使得全身血液循环中药物和活性代谢物水平增加,提高了整体生物利用度并减少了可观察到的毒性。
磷酸肌醇3激酶(PI3K)和丝裂原活化蛋白激酶(MAPK)这两种分子信号通路驱动多种癌症,是实体恶性肿瘤中改变较多的致癌信号通路之一,由于靶点抑制不足、代偿性信号激活和下游靶点趋同,使用单通路抑制剂的临床效率一直很差。即使一种药物阻断了一个通路,另一个通路也可以提供一个逃逸生存通路来补偿和继续生长。
LP-182 在体外和体内均实现了对 PI3K 和 MAPK 信号通路的选择性有效抑制。口服给药导致血浆半衰期延长,这归因于LP-182首先被肠道淋巴系统中活性脂蛋白转运途径吸收。淋巴系统作为一个储存库,将药物从身体的其他部分隔离出来,并随着时间的推移逐渐将药物释放到全身循环中,以保持药物浓度在好的治疗水平。
骨髓纤维化(MF)是一种明显累及继发性淋巴器官(如脾脏)的血液肿瘤。骨髓纤维化主要源于造血干细胞和祖细胞(HSPCs)的突变激活了JAK2激酶。在骨髓纤维化中,骨髓中会形成过多的疤痕组织,破坏正常的血细胞生成。过度活跃的分子信号传导导致恶性干细胞增殖、广泛纤维化、脾脏肿大和进行性骨髓衰竭。标准治疗JAK2抑制剂(Ruxolitinib, Fedratinib)的耐药性已被证明是代偿性PI3K和MAPK生存信号同时激活的结果。
在骨髓增生性白血病癌基因(MPLW515L)小鼠骨髓纤维化(MF)模型的临床前研究表明,LP-182可改善脾肿大和纤维化疾病表型、延长总生存期。MPLW515L小鼠模型口服LP-182还可导致骨髓和分离脾细胞中血液细胞数量的恢复,以及下游蛋白激酶B (PKB/AKT)和细胞外信号调节蛋白激酶1/2 (ERK1/2)信号活性的减弱。

多功能激酶抑制剂LP-182表现出的选择性和特异性
癌症治疗通常涉及针对不同癌细胞弱点的综合治疗。密歇根大学医学院放射学研究教授、第一作者Brian D. Ross博士说,由于这些药物在体内循环、被人体吸收和移除的速度不同,在限制药物毒性和副作用的同时维持每种药物在有效的必要浓度下的正确治疗平衡可能是一项挑战。
“在治疗窗口内,我们能够保持对这两种不同但能相互补偿的信号通路的靶向抑制,”Ross说,“这证明了将抗癌药物直接输送到淋巴系统的可行性,这为改善癌症治疗结果和减少药物本身的副作用打开了巨大的新机会。”
骨髓纤维化通过淋巴组织传播,这也是癌症转移的常见途径,因此Ross和他的团队的发现可能为防止癌症扩散提供新的策略。此外,Ross说,因为肠道的淋巴系统容纳了超过一半的身体免疫细胞,这项研究的结果可以为治疗自身免疫性疾病和其他疾病提供方法。
Ross和他的同事将继续扩大LP-182的临床前研究,目标是在人类骨髓纤维化患者中开展一期临床试验。他们还在开发更多的淋巴靶向激酶抑制剂,用于治疗实体肿瘤,包括乳腺癌、脑癌、胃肠道和胰腺癌,以及狼疮和多发性硬化症等自身免疫性疾病。
该研究的亮点在于证明了制备经由淋巴吸收多靶点激酶抑制剂的合成方案,以及对淋巴吸收中心的物理化学特征的表征,为推进经由淋巴吸收的小分子疗法在人类疾病治疗中的应用提供了一条途径。
参考资料:
[1]Brian D. Ross, Youngsoon Jang, Amanda Welton, Christopher A. Bonham, Dilrukshika S. W. Palagama, Kevin Heist, Jagadish Boppisetti, Kasun P. Imaduwage, Tanner Robison, Leah R. King, Edward Z. Zhang, Cyrus Amirfazli, Kathryn E. Luker, Winston Y. Lee, Gary D. Luker, Thomas L. Chenevert & Marcian E. Van Dort, A lymphatic-absorbed multi-targeted kinase inhibitor for myelofibrosis therapy, Nature Communications volume 13, Article number: 4730 (2022)



