摘要:布法罗大学(University at Buffalo)的研究人员及其合作者已经开发出强大的新方法,来研究并可能逆转导致线粒体疾病和过早衰老的细胞机制。
布法罗大学的研究人员和他们的合作者已经开发出强大的新方法来研究并可能逆转导致线粒体疾病和过早衰老的细胞机制。
线粒体提供了细胞正常运作所需的大部分能量,所以线粒体的基因缺陷可能会导致严重的疾病,如果不及早发现和治疗,这些疾病可能是毁灭性的。
但是这些线粒体缺陷究竟是如何导致疾病和衰老的还没有被很好地理解。发表在《衰老细胞》杂志上的一篇论文揭示了衰老过程中线粒体缺陷和关键信号之间的联系。在《自然通讯》杂志的另一篇论文中,研究人员描述了他们基于光遗传学开发的一项新技术如何帮助异常的线粒体相互作用恢复正常功能。

图1 早衰与高水平的8-氧代鸟嘌呤和DNA损伤增加正相关(图源:[1])
线粒体和端粒
《衰老细胞》的论文将线粒体功能障碍与端粒缩短联系起来,端粒缩短是早衰的关键生物标志物。
布法罗大学雅各布斯医学和生物医学科学学院儿科遗传学系主任、医学博士Taosheng Huang教授解释说:“端粒是一种特殊的DNA序列,起到了稳定染色体末端的帽子的作用。”
“端粒缩短通常被认为是衰老的重要生物标志物,但长期以来,没有人知道其机制。现在我们能够将线粒体功能障碍与端粒缩短直接联系起来,”该论文的资深作者黄说。
实验是用一种名为Polg“mutator”的小鼠模型进行的,这种小鼠携带一种特定的基因缺陷,可以加速线粒体DNA突变的速度。
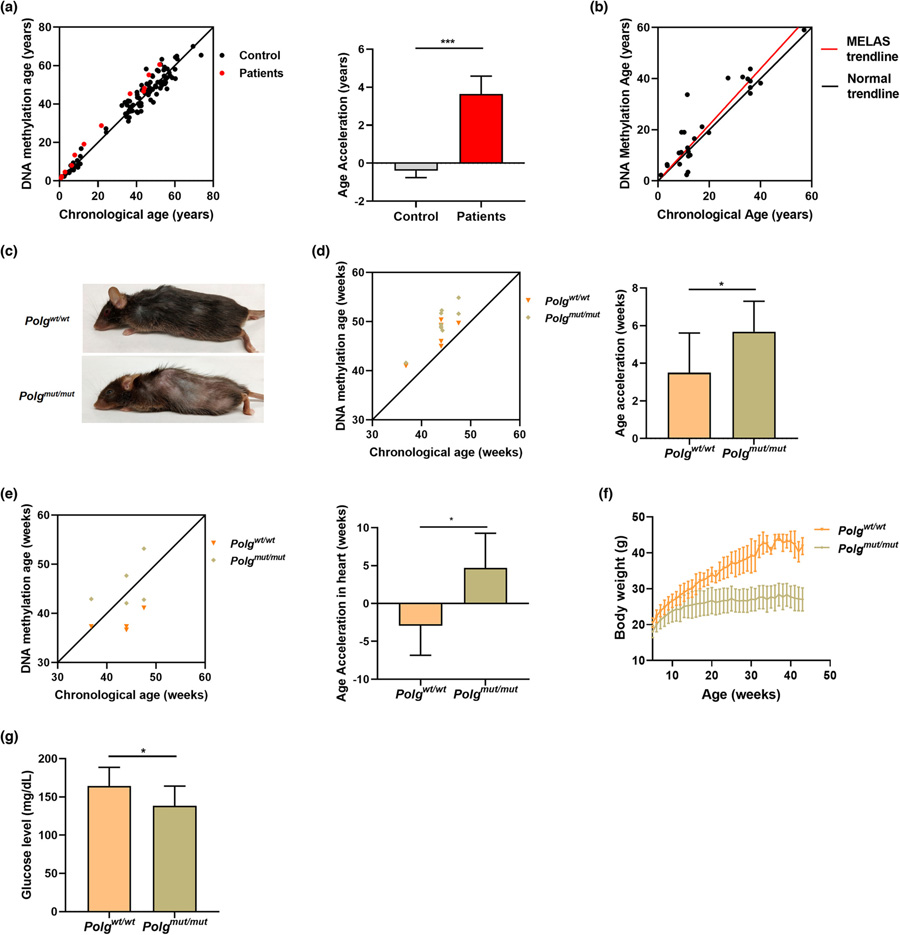
图2 致病性线粒体DNA突变加速了衰老。
Taosheng Huang教授说:“我们还能够在人类身上证明,线粒体DNA中一个核苷酸的变化是如何加速衰老的,这种变化与线粒体功能低下和导致儿童线粒体疾病有关。”“我们发现,随着时间的推移,线粒体功能低下导致的活性氧会增加DNA损伤。”
这篇论文表明,在这个模型中,线粒体DNA突变会产生更快的衰老,正如DNA时钟所显示的那样,它根据DNA中的特定化学标记来估计一个人的生物年龄。
这项研究是所有作者成功合作的结果,包括加州大学洛杉矶分校人类遗传学和生物统计学教授Steve Horvath博士,他开发了DNA钟,以及匹兹堡大学副教授Patricia Opresko博士和曼尼托巴大学的Sabine Mai博士,他们都是端粒和端粒损伤方面的专家。
这项研究是由国家环境与职业健康研究所和国家老龄化研究所资助的,这两家机构都是国家健康研究所。
组织细胞间的相互作用
7月25日,《自然通讯》杂志发表了一篇论文,揭示了光遗传学是如何利用光来操纵细胞活动的,它不仅可以被用作研究工具,还可以被用作实时协调细胞器相互作用的工具。

图3 通过线粒体-溶酶体接触的光遗传学控制光激活线粒体分裂(图源:[2])
这篇论文的重点是线粒体动力学,这些细胞器不断经历的过程,以保持细胞内的健康平衡。它们会发生裂变,一个线粒体分裂成两个,以及融合,两个线粒体融合成一个。细胞中这两种过程之间的不平衡会导致线粒体疾病。
Taosheng Huang说,“在《自然通讯》的论文中,我们描述了一项我们开发的技术,该技术允许我们直接操纵线粒体和细胞中其他细胞器之间的相互作用”。
“通过利用光遗传学迫使线粒体和另一细胞成分溶酶体之间产生物理作用,我们能够恢复线粒体到更正常的大小,同时改善它们的能量生产功能,我们相信,这项新发现可以作为这类疾病未来诊断和治疗的基础。”
这项工作是由于使用了辛辛那提大学的一种强大的成像技术——结构照明显微镜(SIM)而得以实现的,黄在辛辛那提大学担任现任研究员之前就开始了这项研究。SIM允许对活细胞进行极高分辨率的实时成像。
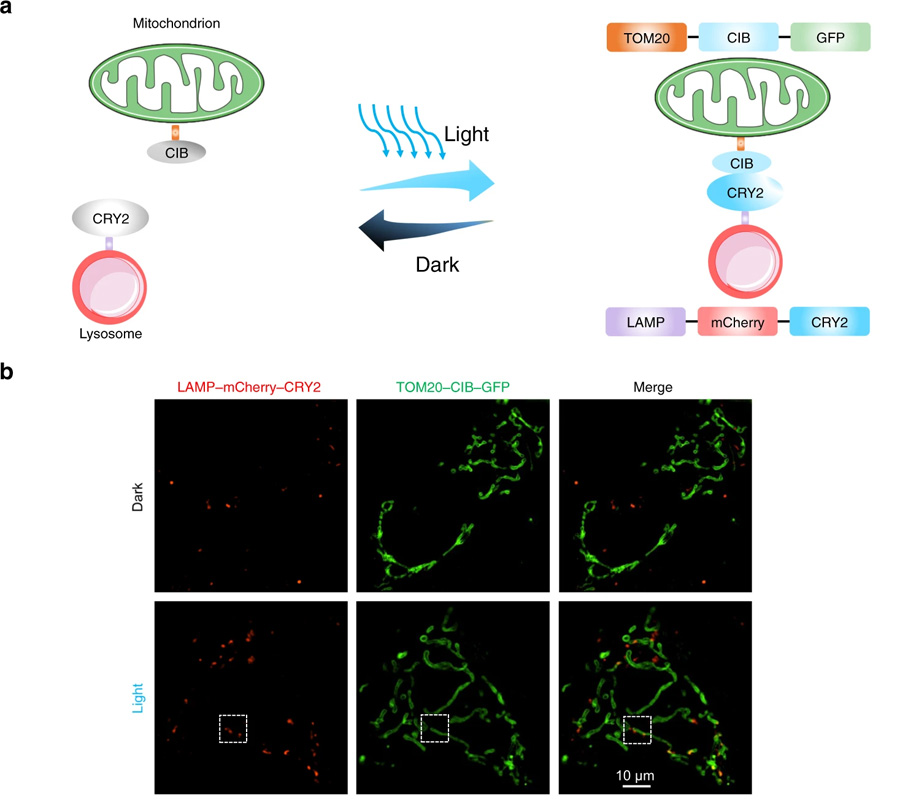
图4 光遗传学可用于诱导线粒体-溶酶体接触(图源:[2])
Taosheng Huang是一名线粒体疾病遗传学方面的专家,在检测和治疗遗传疾病方面开创了开创性的创新。他于2020年从辛辛那提儿童医院医疗中心被招募到UB和John R. Oishei儿童医院。他同时也是奥赛儿童医院遗传与代谢科的医学主任,以及UBMD儿科的人类遗传学主任。
《自然通讯》杂志这篇论文的共同作者来自辛辛那提大学医学院、辛辛那提儿童医院医学中心和伊利诺伊大学厄巴纳-香槟分校。这项研究由美国国立卫生研究院资助。
参考资料:
[1]Premature aging is associated with higher levels of 8-oxoguanine and increased DNA damage in the Polg mutator mouse
[2]Light-activated mitochondrial fission through optogenetic control of mitochondria-lysosome contacts
[2]Light-activated mitochondrial fission through optogenetic control of mitochondria-lysosome contacts
摘要:布法罗大学(University at Buffalo)的研究人员及其合作者已经开发出强大的新方法,来研究并可能逆转导致线粒体疾病和过早衰老的细胞机制。
布法罗大学的研究人员和他们的合作者已经开发出强大的新方法来研究并可能逆转导致线粒体疾病和过早衰老的细胞机制。
线粒体提供了细胞正常运作所需的大部分能量,所以线粒体的基因缺陷可能会导致严重的疾病,如果不及早发现和治疗,这些疾病可能是毁灭性的。
但是这些线粒体缺陷究竟是如何导致疾病和衰老的还没有被很好地理解。发表在《衰老细胞》杂志上的一篇论文揭示了衰老过程中线粒体缺陷和关键信号之间的联系。在《自然通讯》杂志的另一篇论文中,研究人员描述了他们基于光遗传学开发的一项新技术如何帮助异常的线粒体相互作用恢复正常功能。

图1 早衰与高水平的8-氧代鸟嘌呤和DNA损伤增加正相关(图源:[1])
线粒体和端粒
《衰老细胞》的论文将线粒体功能障碍与端粒缩短联系起来,端粒缩短是早衰的关键生物标志物。
布法罗大学雅各布斯医学和生物医学科学学院儿科遗传学系主任、医学博士Taosheng Huang教授解释说:“端粒是一种特殊的DNA序列,起到了稳定染色体末端的帽子的作用。”
“端粒缩短通常被认为是衰老的重要生物标志物,但长期以来,没有人知道其机制。现在我们能够将线粒体功能障碍与端粒缩短直接联系起来,”该论文的资深作者黄说。
实验是用一种名为Polg“mutator”的小鼠模型进行的,这种小鼠携带一种特定的基因缺陷,可以加速线粒体DNA突变的速度。

图2 致病性线粒体DNA突变加速了衰老。
Taosheng Huang教授说:“我们还能够在人类身上证明,线粒体DNA中一个核苷酸的变化是如何加速衰老的,这种变化与线粒体功能低下和导致儿童线粒体疾病有关。”“我们发现,随着时间的推移,线粒体功能低下导致的活性氧会增加DNA损伤。”
这篇论文表明,在这个模型中,线粒体DNA突变会产生更快的衰老,正如DNA时钟所显示的那样,它根据DNA中的特定化学标记来估计一个人的生物年龄。
这项研究是所有作者成功合作的结果,包括加州大学洛杉矶分校人类遗传学和生物统计学教授Steve Horvath博士,他开发了DNA钟,以及匹兹堡大学副教授Patricia Opresko博士和曼尼托巴大学的Sabine Mai博士,他们都是端粒和端粒损伤方面的专家。
这项研究是由国家环境与职业健康研究所和国家老龄化研究所资助的,这两家机构都是国家健康研究所。
组织细胞间的相互作用
7月25日,《自然通讯》杂志发表了一篇论文,揭示了光遗传学是如何利用光来操纵细胞活动的,它不仅可以被用作研究工具,还可以被用作实时协调细胞器相互作用的工具。

图3 通过线粒体-溶酶体接触的光遗传学控制光激活线粒体分裂(图源:[2])
这篇论文的重点是线粒体动力学,这些细胞器不断经历的过程,以保持细胞内的健康平衡。它们会发生裂变,一个线粒体分裂成两个,以及融合,两个线粒体融合成一个。细胞中这两种过程之间的不平衡会导致线粒体疾病。
Taosheng Huang说,“在《自然通讯》的论文中,我们描述了一项我们开发的技术,该技术允许我们直接操纵线粒体和细胞中其他细胞器之间的相互作用”。
“通过利用光遗传学迫使线粒体和另一细胞成分溶酶体之间产生物理作用,我们能够恢复线粒体到更正常的大小,同时改善它们的能量生产功能,我们相信,这项新发现可以作为这类疾病未来诊断和治疗的基础。”
这项工作是由于使用了辛辛那提大学的一种强大的成像技术——结构照明显微镜(SIM)而得以实现的,黄在辛辛那提大学担任现任研究员之前就开始了这项研究。SIM允许对活细胞进行极高分辨率的实时成像。

图4 光遗传学可用于诱导线粒体-溶酶体接触(图源:[2])
Taosheng Huang是一名线粒体疾病遗传学方面的专家,在检测和治疗遗传疾病方面开创了开创性的创新。他于2020年从辛辛那提儿童医院医疗中心被招募到UB和John R. Oishei儿童医院。他同时也是奥赛儿童医院遗传与代谢科的医学主任,以及UBMD儿科的人类遗传学主任。
《自然通讯》杂志这篇论文的共同作者来自辛辛那提大学医学院、辛辛那提儿童医院医学中心和伊利诺伊大学厄巴纳-香槟分校。这项研究由美国国立卫生研究院资助。
参考资料:
[1]Premature aging is associated with higher levels of 8-oxoguanine and increased DNA damage in the Polg mutator mouse
[2]Light-activated mitochondrial fission through optogenetic control of mitochondria-lysosome contacts
[2]Light-activated mitochondrial fission through optogenetic control of mitochondria-lysosome contacts



