摘要:研究人员阐明了癌症和妊娠中共同的免疫耐受机制。
在最近发表在Cell杂志上的一项研究中,一组研究人员阐明了癌症和妊娠中共同的免疫耐受机制,重点研究了孕激素诱导的B7同源物4 (B7- h4)(一种免疫检查点蛋白)作为肿瘤胎儿免疫耐受检查点的作用(允许癌症和胎儿细胞免疫共存的机制)。
免疫检查点阻断(ICB)在各种癌症中引起持久的反应。然而,由于关键的免疫调节机制在肿瘤微环境(TME)中促进抑制网络,大多数患者对当前的免疫治疗没有反应。这导致癌症免疫逃避和对ICB的抵抗。

图1 孕激素驱动的B7-H4有助于癌胚免疫耐受
妊娠是探索免疫耐受的理想模型,与癌症共享关键的免疫抑制途径,包括程序性死亡配体1 (PD-L1)、人白细胞抗原G (HLA-G)、吲哚胺2,3-双加氧酶(IDO)和Tregs。B7-H4靶向治疗癌症和妊娠相关免疫耐受的机制和治疗潜力有待进一步研究。
在动物实验中,采用醋酸甲孕酮(MPA)和7,12-二甲基苯[A]蒽(DMBA)诱导自发性肿瘤模型。将年龄匹配的雌性野生型(WT)和B7-H4-/-小鼠皮下植入含有缓释MPA的微丸。小鼠每周灌胃DMBA 1 mg,共6次。
监测肿瘤生长情况,记录可评估的肿瘤数量。用卡尺测量肿瘤尺寸,计算肿瘤面积。监测无肿瘤生存期和总生存期。为了建立可移植的肿瘤,从肿瘤结节中分离原代细胞,并皮下接种到WT小鼠体内传代。这些细胞被用来建立皮下移植肿瘤,用于米非司酮(RU486)、BD-9136或抗PD- l1治疗模型。
将小鼠随机分为治疗组,监测无肿瘤生存和总生存。小鼠子宫内膜上皮细胞(MEECs)上B7-H4的表达通过给药RU486和收获子宫分离细胞来检测。
在妊娠模型中,将雌性C57BL/6 (WT)和B7-H4-/-小鼠分别与雄性Bagg Albino、C系(BALB/ C)(实验室小鼠常见近交系)和C57BL/6小鼠进行异基因和同基因交配。在妊娠第13.5天对孕鼠实施安乐死,记录全胎数和再吸收胎数。计算胎儿吸收率。分化簇(CD4)和CD8 T细胞(识别和破坏感染细胞或癌细胞的淋巴细胞)被特异性抗体耗尽,并通过流式细胞术证实了耗尽效率。胚胎移植是通过用妊娠母马血清促性腺激素(PMSG)和人绒毛膜促性腺激素(hCG)处理WT和B7-H4-/-雌性小鼠,与各自的雄性交配,并将两细胞胚胎移植给受体小鼠进行的。在妊娠第13.5或14.5天检查妊娠结局。
研究结果
为了探索以前未被认识的肿瘤胎儿免疫耐受机制,交叉分析了来自不同TME和胎盘的14个单细胞RNA测序(scRNA-seq)数据集,重点分析了肿瘤和滋养细胞的“非自体”细胞成分。考虑到主要组织相容性复合体(MHC)和辅助分子在免疫应答中的重要性,我们评估了MHC、关键B7家族成员和TNF家族成员的表达模式。
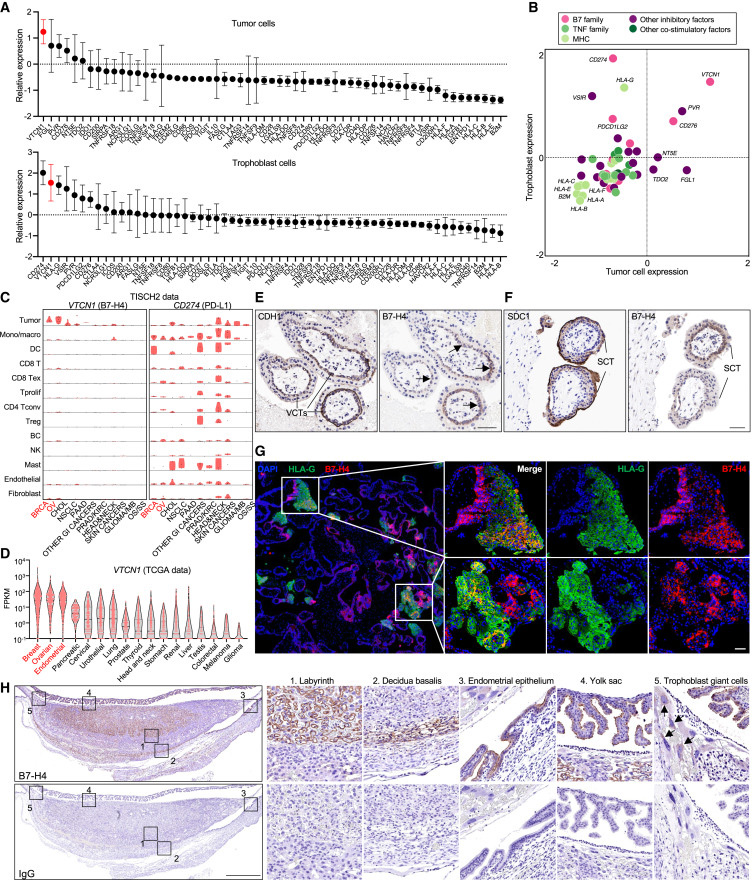
图2 B7-H4是一种癌胚免疫耐受检查点
该分析证实了先前报道的在肿瘤和滋养细胞中表达的关键基因。例如,在肿瘤细胞中发现高纤维蛋白原样蛋白1 (FGL1)表达,在胎盘滋养细胞中发现高HLA-G表达。有趣的是,B7-H4 V-Set Domain Containing T Cell Activation Inhibitor 1 (VTCN1)在TME和胎盘滋养层细胞的肿瘤细胞中被列为高表达的基因。因此,B7-H4转录本在TME和胎盘的主要细胞成分中均有表达。
将分析扩展到肿瘤免疫单细胞中心2 (TISCH2)数据库,比较B7-H4和PD-L1 (B7-H1, CD274)的表达模式。B7-H4主要在肿瘤细胞中表达,而包括髓系细胞在内的不同细胞类型均广泛表达PD-L1。在许多癌症类型中,B7-H4转录物水平最高的是源于女性生殖器官的癌症,如乳腺癌和卵巢癌。
该scRNA-seq数据分析与来自癌症基因组图谱(TCGA)的大量RNA-seq数据一致,显示乳腺癌、卵巢癌和子宫内膜癌中B7-H4转录物水平最高。乳腺癌和子宫内膜癌中检测到高水平的B7-H4蛋白,宫颈癌中检测到中等水平的B7-H4蛋白。因此,B7-H4转录物和蛋白在泛妇科癌症中高度表达。
在母胎界面,B7-H4主要由滋养细胞表达。人类滋养细胞由解剖学和功能上不同的亚群组成,包括绒毛外滋养细胞(EVTs)、绒毛细胞滋养细胞(VCTs)和合胞滋养细胞(SCT)。我们分析了人类妊娠早期滋养细胞亚群中B7-H4转录本的表达,这是建立母胎免疫耐受的关键阶段。HLA-G主要在EVTs中表达,CD274在EVTs和SCT中表达,VTCN1在所有三个滋养细胞亚群中表达。在体外分化的EVTs中也检测到VTCN1转录本。
免疫组化(IHC)染色显示,人妊娠早期受胎细胞(POCs)的HLA-G+EVTs表达B7-H4蛋白。多重免疫组化染色显示B7-H4和HLA-G在EVTs中同时表达。滋养细胞JEG-3(人胎盘绒毛膜癌细胞系)也同时表达HLA-G和B7-H4。vct和SCT表达不同水平的B7-H4蛋白。与先前的报道一致,羊膜上皮细胞也表达B7-H4,在人母胎界面提供了另一种B7-H4+细胞类型。
结论
综上所述,免疫耐受对于癌症进展和对ICB的抵抗以及怀孕期间胎儿的成功发育都是至关重要的。一些免疫抑制途径,如PD-L1、HLA-G、吲哚胺2,3-双加氧酶(IDO)和Tregs,在TME和胎盘之间是共享的。
本研究确定B7-H4是一个以前未被识别的由孕激素信号驱动的肿瘤胎儿免疫耐受检查点。B7-H4支持TME和母胎界面的局部免疫抑制,确保这些部位在癌症进展和妊娠期间保持免疫特权。这种分子调控有助于更广泛的细胞免疫抑制网络,这对两种情况下的免疫耐受至关重要。
参考资料
[1] Progestogen-driven B7-H4 contributes to onco-fetal immune tolerance
摘要:研究人员阐明了癌症和妊娠中共同的免疫耐受机制。
在最近发表在Cell杂志上的一项研究中,一组研究人员阐明了癌症和妊娠中共同的免疫耐受机制,重点研究了孕激素诱导的B7同源物4 (B7- h4)(一种免疫检查点蛋白)作为肿瘤胎儿免疫耐受检查点的作用(允许癌症和胎儿细胞免疫共存的机制)。
免疫检查点阻断(ICB)在各种癌症中引起持久的反应。然而,由于关键的免疫调节机制在肿瘤微环境(TME)中促进抑制网络,大多数患者对当前的免疫治疗没有反应。这导致癌症免疫逃避和对ICB的抵抗。

图1 孕激素驱动的B7-H4有助于癌胚免疫耐受
妊娠是探索免疫耐受的理想模型,与癌症共享关键的免疫抑制途径,包括程序性死亡配体1 (PD-L1)、人白细胞抗原G (HLA-G)、吲哚胺2,3-双加氧酶(IDO)和Tregs。B7-H4靶向治疗癌症和妊娠相关免疫耐受的机制和治疗潜力有待进一步研究。
在动物实验中,采用醋酸甲孕酮(MPA)和7,12-二甲基苯[A]蒽(DMBA)诱导自发性肿瘤模型。将年龄匹配的雌性野生型(WT)和B7-H4-/-小鼠皮下植入含有缓释MPA的微丸。小鼠每周灌胃DMBA 1 mg,共6次。
监测肿瘤生长情况,记录可评估的肿瘤数量。用卡尺测量肿瘤尺寸,计算肿瘤面积。监测无肿瘤生存期和总生存期。为了建立可移植的肿瘤,从肿瘤结节中分离原代细胞,并皮下接种到WT小鼠体内传代。这些细胞被用来建立皮下移植肿瘤,用于米非司酮(RU486)、BD-9136或抗PD- l1治疗模型。
将小鼠随机分为治疗组,监测无肿瘤生存和总生存。小鼠子宫内膜上皮细胞(MEECs)上B7-H4的表达通过给药RU486和收获子宫分离细胞来检测。
在妊娠模型中,将雌性C57BL/6 (WT)和B7-H4-/-小鼠分别与雄性Bagg Albino、C系(BALB/ C)(实验室小鼠常见近交系)和C57BL/6小鼠进行异基因和同基因交配。在妊娠第13.5天对孕鼠实施安乐死,记录全胎数和再吸收胎数。计算胎儿吸收率。分化簇(CD4)和CD8 T细胞(识别和破坏感染细胞或癌细胞的淋巴细胞)被特异性抗体耗尽,并通过流式细胞术证实了耗尽效率。胚胎移植是通过用妊娠母马血清促性腺激素(PMSG)和人绒毛膜促性腺激素(hCG)处理WT和B7-H4-/-雌性小鼠,与各自的雄性交配,并将两细胞胚胎移植给受体小鼠进行的。在妊娠第13.5或14.5天检查妊娠结局。
研究结果
为了探索以前未被认识的肿瘤胎儿免疫耐受机制,交叉分析了来自不同TME和胎盘的14个单细胞RNA测序(scRNA-seq)数据集,重点分析了肿瘤和滋养细胞的“非自体”细胞成分。考虑到主要组织相容性复合体(MHC)和辅助分子在免疫应答中的重要性,我们评估了MHC、关键B7家族成员和TNF家族成员的表达模式。

图2 B7-H4是一种癌胚免疫耐受检查点
该分析证实了先前报道的在肿瘤和滋养细胞中表达的关键基因。例如,在肿瘤细胞中发现高纤维蛋白原样蛋白1 (FGL1)表达,在胎盘滋养细胞中发现高HLA-G表达。有趣的是,B7-H4 V-Set Domain Containing T Cell Activation Inhibitor 1 (VTCN1)在TME和胎盘滋养层细胞的肿瘤细胞中被列为高表达的基因。因此,B7-H4转录本在TME和胎盘的主要细胞成分中均有表达。
将分析扩展到肿瘤免疫单细胞中心2 (TISCH2)数据库,比较B7-H4和PD-L1 (B7-H1, CD274)的表达模式。B7-H4主要在肿瘤细胞中表达,而包括髓系细胞在内的不同细胞类型均广泛表达PD-L1。在许多癌症类型中,B7-H4转录物水平最高的是源于女性生殖器官的癌症,如乳腺癌和卵巢癌。
该scRNA-seq数据分析与来自癌症基因组图谱(TCGA)的大量RNA-seq数据一致,显示乳腺癌、卵巢癌和子宫内膜癌中B7-H4转录物水平最高。乳腺癌和子宫内膜癌中检测到高水平的B7-H4蛋白,宫颈癌中检测到中等水平的B7-H4蛋白。因此,B7-H4转录物和蛋白在泛妇科癌症中高度表达。
在母胎界面,B7-H4主要由滋养细胞表达。人类滋养细胞由解剖学和功能上不同的亚群组成,包括绒毛外滋养细胞(EVTs)、绒毛细胞滋养细胞(VCTs)和合胞滋养细胞(SCT)。我们分析了人类妊娠早期滋养细胞亚群中B7-H4转录本的表达,这是建立母胎免疫耐受的关键阶段。HLA-G主要在EVTs中表达,CD274在EVTs和SCT中表达,VTCN1在所有三个滋养细胞亚群中表达。在体外分化的EVTs中也检测到VTCN1转录本。
免疫组化(IHC)染色显示,人妊娠早期受胎细胞(POCs)的HLA-G+EVTs表达B7-H4蛋白。多重免疫组化染色显示B7-H4和HLA-G在EVTs中同时表达。滋养细胞JEG-3(人胎盘绒毛膜癌细胞系)也同时表达HLA-G和B7-H4。vct和SCT表达不同水平的B7-H4蛋白。与先前的报道一致,羊膜上皮细胞也表达B7-H4,在人母胎界面提供了另一种B7-H4+细胞类型。
结论
综上所述,免疫耐受对于癌症进展和对ICB的抵抗以及怀孕期间胎儿的成功发育都是至关重要的。一些免疫抑制途径,如PD-L1、HLA-G、吲哚胺2,3-双加氧酶(IDO)和Tregs,在TME和胎盘之间是共享的。
本研究确定B7-H4是一个以前未被识别的由孕激素信号驱动的肿瘤胎儿免疫耐受检查点。B7-H4支持TME和母胎界面的局部免疫抑制,确保这些部位在癌症进展和妊娠期间保持免疫特权。这种分子调控有助于更广泛的细胞免疫抑制网络,这对两种情况下的免疫耐受至关重要。
参考资料
[1] Progestogen-driven B7-H4 contributes to onco-fetal immune tolerance



